Коррозия и защита от коррозииЦинк
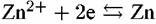 равен —0,76 В. В 3 %-м растворе NaCl электродный потенциал цинка равен —0,83 В. равен —0,76 В. В 3 %-м растворе NaCl электродный потенциал цинка равен —0,83 В.
Цинк может корродировать как с водородной, так и с кислородной деполяризацией.
В кислых средах цинк корродирует с водородной деполяризацией. На скорость коррозии цинка существенно влияют даже незначительные примеси других металлов. Примеси кадмия, свинца, алюминия не влияют на скорость коррозии. Примеси с низким перенапряжением водорода, например, железо, медь в концентрации 0,002-0,005 % увеличивают скорость коррозии цинка в 10 и более раз.
В нейтральных растворах цинк корродирует с кислородной деполяризацией и имеющиеся в нем технические примеси не влияют на его коррозионную устойчивость. На поверхности металла образуются защитные пленки из гидроксида цинка.
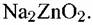
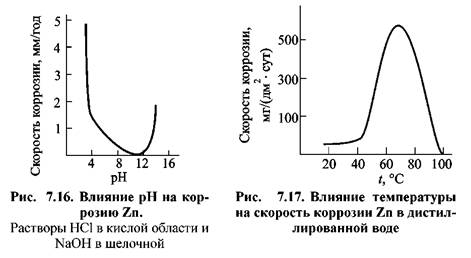
Цинк обладает максимальной устойчивостью в интервале рН между 9 и 11 (рис. 7.16). Применение цинковых покрытий нерационально, если рН среды заметно меньше 7 или более 12 из-за усиления коррозии цинка.
В воде цинк устойчив до 55 °С (рис. 7.17). Скорость коррозии резко повышается с увеличением температуры и достигает максимума при 70 °С, а затем снижается. Наблюдаемые закономерности связывают с тем, что при температурах до 50 °С и выше 95 °С, на цинке образуется плотная пленка с высокими защитными свойствами. В интервале температур (55-65)°С наблюдается образование рыхлых продуктов коррозии с низкими защитными свойствами. При 100° С продукты коррозии уплотняются, а также происходит уменьшение растворимости кислорода в коррозионной среде.
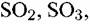 НС1 средах индустриальных районов устойчивость цинка и цинковых покрытий заметно снижается. Цинк используется для защиты стали от атмосферной коррозии. Применяется для получения медных, никелевых, магниевых сплавов, в производстве аккумуляторов и как протектор при электрохимической защите железных сплавов. НС1 средах индустриальных районов устойчивость цинка и цинковых покрытий заметно снижается. Цинк используется для защиты стали от атмосферной коррозии. Применяется для получения медных, никелевых, магниевых сплавов, в производстве аккумуляторов и как протектор при электрохимической защите железных сплавов.
|