Коррозия и защита от коррозииТермодинамика электрохимической коррозии
Причиной электрохимической коррозии является термодинамическая неустойчивость металлов в среде электролита.
Величина равновесного потенциала зависит от температуры и активности реагирующих веществ и может быть рассчитана по уравнению Нернста:
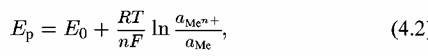 ) )
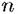 — число электронов, участвующих в реакции. Если представить все константы при температуре 298 К и выразить зависимость в десятичных логарифмах, то — число электронов, участвующих в реакции. Если представить все константы при температуре 298 К и выразить зависимость в десятичных логарифмах, то

Если активность ионов металла в растворе равна единице, то второй член уравнения Нернста превращается в нуль. Электродный потенциал при этом становится равным стандартному потенциалу. Таким образом стандартный электродный потенциал представляет собой частный случай равновесного потенциала. Значение стандартных потенциалов для некоторых металлов приведены в табл. 4.1.
В реальных условиях коррозии металла в реакциях обмена участвуют не только ионы металла, но и другие компоненты раствора.
В этих случаях устанавливаются стационарные или необратимые значения потенциалов. Необратимые потенциалы не могут быть отнесены к прямой и обратной реакциям одного и того же процесса и их нельзя вычислить по уравнению Нернста.
Измерить абсолютное значение потенциала в настоящее время технически невозможно, он может быть замерен только по отношению к какому-то электроду сравнения. В качестве основного электрода сравнения принят стандартный водородный электрод. Наиболее часто в качестве электрода сравнения применяют каломельный и хлор-серебряный электроды.
Существуют и другие виды электродов сравнения, с которыми можно более подробно познакомиться в учебниках по физической химии и электрохимии.
В настоящей книге в таблицах и на графиках потенциалы приведены по отношению к стандартному водородному электроду (с. в. э.).
Процесс электрохимической коррозии представляет собой совокупность двух сопряженно протекающих реакций.
Металл является донором электронов и на его поверхности протекает анодная реакция:
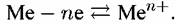
Катодная реакция, которую называют катодной деполяризующей реакцией, протекает с участием компонентов электропроводящей среды. В качестве последней чаще всего выступают водные растворы кислот, щелочей или солей.
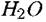 (водородная деполяризация): (водородная деполяризация):
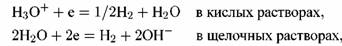
 (кислородная деполяризация): (кислородная деполяризация):

рН влияет на величину равновесного потенциала.
Запишем уравнение Нернста для водородной деполяризации:
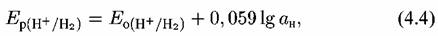
Если учесть, что стандартный потенциал водородного электрода принят равным нулю, а десятичный логарифм активности водородных ионов есть величина рН, взятая с обратным знаком, то получим:

Это означает, что при изменении рН на единицу потенциал водородного электрода уменьшается на 59 мВ.
Потенциал кислородного электрода положительнее водородного электрода на 1,23 В, т.е.
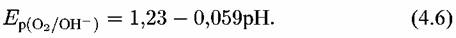
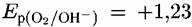 В. В нейтральной среде при рН = 7 и при В. В нейтральной среде при рН = 7 и при
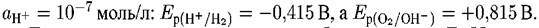 электрохимических реакций свободная энергия Гиббса рассчитывается по уравнению электрохимических реакций свободная энергия Гиббса рассчитывается по уравнению


|