Коррозия и защита от коррозииДиаграммы пурбе
 . Последние получили название диаграмм Пурбе. . Последние получили название диаграмм Пурбе.
Диаграммы используют для определения границ термодинамической устойчивости соединений и заключений о возможности протекания реакций. В последнее время получили распространение комплексные исследования, в том числе и с использованием диаграмм Пурбе, для разработки отдельных моделей коррозионных процессов. При построении диаграмм учитывают три типа равновесий в системе металл—вода.
1. Равновесный обмен электрическими зарядами:

Эти равновесия не зависят от рН, а зависят только от потенциала. Линии, которые характеризуют этот процесс, параллельны оси рН.
2. Ионно-молекулярные равновесия, не связанные с величиной потенциала. Они зависят только от величины рН:
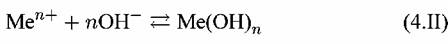
Па диаграмме Пурбе им отвечают линии, параллельные оси потенциалов.
3. Равновесия, которые зависят как от потенциала, так и от рН:
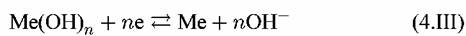
Потенциал такого электрода определяется уравнением:
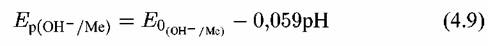
Линия равновесия имеет наклон относительно двух осей.
 для воды (рис. для воды (рис.
4.2). Основные реакции и соответствующие им уравнения приведены в таблице 4.2. Линии 2 и 3 соответствуют электрохимическим равновесиям воды с продуктами ее восстановления — водородом (линия 2) и окисления — кислородом (линия 3). При потенциалах, лежащих выше линии 3, вода окисляется, а при потенциалах ниже линии 2 — восстанавливается.
Кривые 2 и 3 приведены для случая, когда активности ионов равны 1.

 , находящихся в равновесии друг с другом. В таблице 4.2 , находящихся в равновесии друг с другом. В таблице 4.2
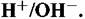
Часто линию 2 обозначают буквой б, а линию 3 буквой а. Их наносят в виде пунктира на диаграммы Пурбе системы элемент-вода для выделения области устойчивости воды.
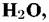 в которой возможно образование нескольких различных ионов (табл. 4.3). в которой возможно образование нескольких различных ионов (табл. 4.3).
Диаграмма имеет четыре области (рис. 4.3):
 (область катодной защиты); (область катодной защиты);
 (области коррозии); (области коррозии);
III — область пассивности.
Линия 1 отвечает условию равновесия процесса ионизации цинка. Ниже этой линии находится область термодинамической


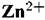 , в области IV — анионы , в области IV — анионы
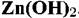
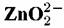
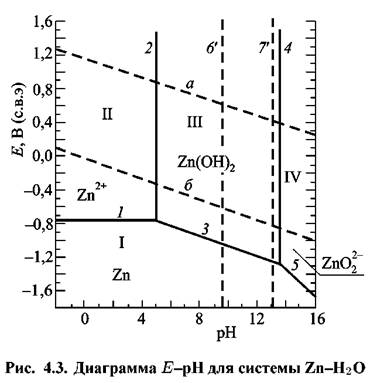
Линии 2 и4 отвечают равновесию химических реакций и поэтому не зависят от потенциала.
 , которые зависят от потенциала и рН. , которые зависят от потенциала и рН.

При разработке термодинамической модели пассивного состояния хрома в кислых растворах использовали комплексный метод исследования. Он включал термодинамические расчеты и построение диаграммы Пурбе, экспериментальные электрохимические исследования и определение свойств поверхностных пленок методами т $Ш (в месте нахождения) и регяе (само по себе), т.е. после отделения пленки от поверхности металла.
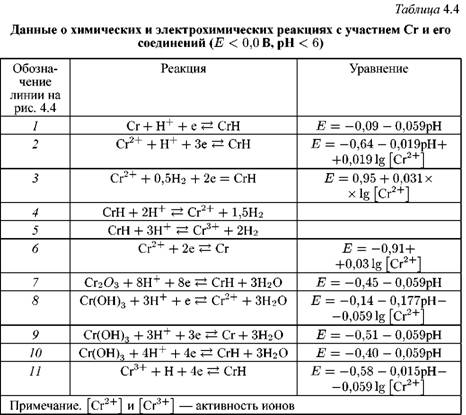
На рис. 4.4 линии, обозначенные цифрами, отражают состояние равновесия и получены расчетным путем для реакций, приведенных в табл. 4.4. Кривые А и В построены по экспериментальным данным резистометрических поляризационных кривых, т.е. при определении местной скорости коррозии в условиях, когда из-за наложения катодного тока выделения Н2 скорость анодного растворения металла не эквивалентна измеряемой анодной плотности тока.
 на на
поверхности металлического хрома.
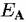 — —
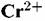 прекращается и начинается реакция гидратообразования. прекращается и начинается реакция гидратообразования.
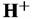 , он отвечает структуре двойной пленки , он отвечает структуре двойной пленки
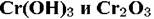 становится одинаково возможным. становится одинаково возможным.
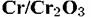 реализуется п-р-контакт, обладающий вентильным действием и затрудняющий протекание анодного процесса. реализуется п-р-контакт, обладающий вентильным действием и затрудняющий протекание анодного процесса.
При росте потенциала в пленке появляется примесь Сг(У1), что приводит к улучшению ее защитных свойств. Степень гидратации пленки уменьшается. Дальнейшее повышение потенциала приводит к образованию высших оксидов хрома. Эти оксиды анодно или химически образуют хроматы, переходящие в раствор.
|