Коррозия и защита от коррозииСтадия замедленного разряда — ионизации
Если самой медленной стадией электрохимического процесса является переход заряженных частиц через границу раздела фаз, то имеет место замедленная стадия разряда — ионизация.
Теория, описывающая кинетические закономерности переноса заряда через границу раздела фаз, называется теорией замедленного разряда. Впервые в качественной форме она была сформулирована М. Фольмером и А.Н. Фрумкиным.
Основная причина влияния скачка потенциала на скорость электрохимических реакций заключается в том, что скорость таких реакций лимитируется стадией переноса заряда, энергия активации которого является функцией потенциала на границе металл-раствор. В подобных случаях количественная связь между скоростью электрохимического процесса и электродным потенциалом описывается уравнением, носящим название уравнение Фольмера-Фрумкина. Применительно к реакции (4.1) для простейшего случая протекания процесса в одну стадию, т.е. при одновременном отщеплении п электронов, это уравнение имеет вид:

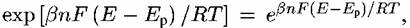 где е — основание натурального логарифма. где е — основание натурального логарифма.
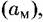 как правило — величина постоянная, так что уравнение (4.18) следует переписать в виде: как правило — величина постоянная, так что уравнение (4.18) следует переписать в виде:
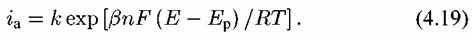
В форме, наиболее удобной для практического использования, уравнение (4.19) целесообразно прологарифмировать:

— характеристика скорости растворения металла.
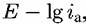 , широко используемых при решении научных и прикладных задач, связанных с исследованием электрохимического растворения металлов). , широко используемых при решении научных и прикладных задач, связанных с исследованием электрохимического растворения металлов).
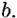
 * является важной характеристикой и в ряде случаев служит аргументом для заключений о кинетике электрохимических реакций. * является важной характеристикой и в ряде случаев служит аргументом для заключений о кинетике электрохимических реакций.
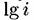 позволяет сделать заключение о числе электронов, участвующих в реакции. Рассмотрим случай, когда происходит растворение металла в одну стадию: позволяет сделать заключение о числе электронов, участвующих в реакции. Рассмотрим случай, когда происходит растворение металла в одну стадию:
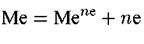
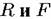 получаем: получаем:
для случая п = 1 величина b = 118 мВ;
для случая п = 2 величина b = 59 мВ.
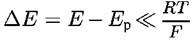 (чаще всего, когда (чаще всего, когда
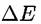 не превышает 25 мВ), можно разложить экспоненту в ряд и тогда получается: не превышает 25 мВ), можно разложить экспоненту в ряд и тогда получается:
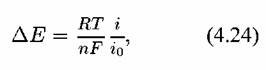
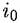 — плотность тока обмена. — плотность тока обмена.
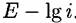
Участок АВ отвечает малому
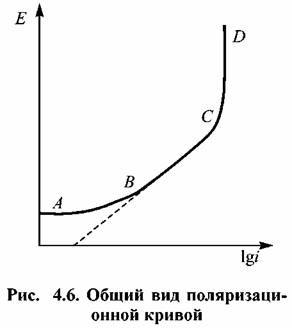
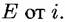 На участке На участке
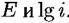 , И, наконец, , И, наконец,
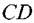 — это область предельного диффузионного тока. — это область предельного диффузионного тока.
Основные закономерности, разобранные в этом разделе, применимы при анализе реакций, лежащих в основе процесса электрохимической коррозии.
|