Коррозия и защита от коррозииЗакономерности растворения металлов в активном состоянии
Растворение металлов в области активного состояния характеризуется линейной зависимостью между потенциалом Е и логарифмом плотности тока.
При рассмотрении механизма анодной реакции растворения металлов возникает вопрос: связан ли переход металла из кристаллической решетки в раствор с одновременным (в одном акте) отщеплением всех п валентных электронов, участвующих в реакции (4.IV), или такое отщепление осуществляется через ряд последовательных, например, одноэлектронных стадий:

К настоящему времени однозначно установлено, что в подавляющем большинстве случаев процессы растворения металлов многостадийны.
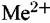 (т.е. при п = 2). Такой процесс можно представить в виде схемы: (т.е. при п = 2). Такой процесс можно представить в виде схемы:
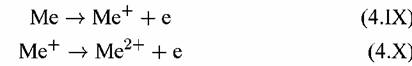 I I
В этом случае возможны два варианта:
1. Стадия (4.IX) протекает заметно медленнее следующей за ней стадии (4.Х) и поэтому лимитирует суммарную скорость процесса. Из тафелевой зависимости для первой стадии
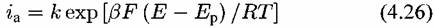

 = 0,5) и окажется, таким образом, равным 118мВ (см. = 0,5) и окажется, таким образом, равным 118мВ (см.
раздел 4.4.2)
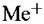 до металла). Тогда на металле установится равновесие до металла). Тогда на металле установится равновесие

Соответствующий этому равновесию потенциал будет определяться уравнением:
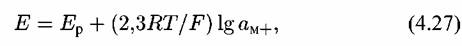
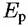 — равновесный потенциал реакции (4.XI). Если подставить Е из уравнения (4.27) в уравнение (4.20), то после преобразований получим уравнение: — равновесный потенциал реакции (4.XI). Если подставить Е из уравнения (4.27) в уравнение (4.20), то после преобразований получим уравнение:
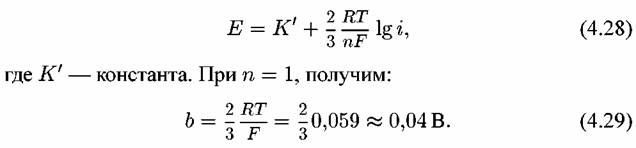
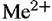 по двух-стадийному механизму с замедленной стадией отщепления второго электрона. по двух-стадийному механизму с замедленной стадией отщепления второго электрона.
|