Технология переработки нефти и газа. Часть 1Основные стадии промежуточного взаимодействия при гетерогенном катализе
В простейшем случае мономолекулярной реакции, приводящей к изомеризации или диссоциации вещества А:
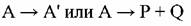
каталитическое превращение может включать следующие стадии:
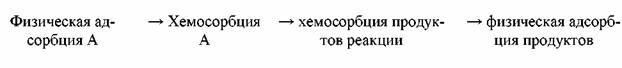
Изменение энергии вдоль пути реакции представлено на рис. 2.2. Физическая адсорбция (точка II) протекает с большой скоростью без энергии активации и приводит к равновесному покрытию поверхности катализатора. С повышением температуры равновесное покрытие уменьшается, и начиная с определенной температуры может непосредственно осуществляться хемосорбция. Хемосорбция реагирующего вещества осуществляется через активированный комплекс (точка 1), энергия которого превышает энергию реагирующего вещества, т.е. в большинстве случаев характеризуется определенной энергией активации. Величина энергии активации (Е2) определяет скорость хемосорбции.
При хемосорбции (точка III) происходит смещение электронной плотности, приводящее к ослаблению или разрыву некоторых связей в молекуле реагирующего вещества и образованию новых связей с поверхностными атомами твердого катализатора. Эти изменения могут в определенных случаях приводить к уменьшению энергии активации превращения реактанта в хемосорбированные продукты реакции (IV) через активированный комплекс (2). Энергия активации (Е2) характеризует скорость этого этапа и зависит от рода химического превращения и природы реактанта и катализатора, определяющих строение и энергию продукта хемосорбции.
Десорбция продуктов реакции также связана с энергией активации (Е3), тем большей, чем выше теплота хемосорбции продуктов реакции. Десорбция физически адсорбированных продуктов реакции требует энергии активации, равной теплоте их физической адсорбции, которая много ниже теплоты хемосорбции, и поэтому покрытие поверхности катализатора физически адсорбированными продуктами реакции всегда очень близко к равновесному.
Скорости стадий хемосорбции, химического превращения и десорбции характеризуются различными значениями энергии активации в зависимости от природы катализатора и реагирующего вещества. Следует отметить, что предэкспоненциальные множители разных стадий различны, и нельзя поэтому утверждать, что всегда наиболее медленной будет стадия с самым высоким энергетическим пиком. Так, в рассматриваемом случае мономолекулярной реакции скорость хемосорбции

Здесь f1#, f2#, f3# суммы состояний активированных комплексов; fA, fK, fX, fY - суммы состояний реагирующего вещества в газовой фазе, участков на поверхности катализатора, на которых осуществляется хемосорбция, хемосорбированных молекул реактанта и хемосорбированных молекул продукта; Е — энергия активации; [А] — концентрация реагирующего вещества в газовой фазе, моль/см3; [К] число свободных участков, отнесенное к 1 см3 газовой фазы; [X] - то же, для участков, занятых хемосорбированными молекулами реагирующего вещества; [Y] - то же, для участков, занятых хемосорбированными молекулами продукта.
Если К, X, Y и активированные комплексы локализованы на поверхности и обладают только колебательными степенями свободы, то значения fK, fX, fY, fi# близки к 1.
Тогда соотношения скоростей стадий, отнесенных к одному участку поверхности, участвующему в реакции,
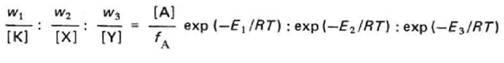
Сумма состояний многоатомной молекулы в газовой фазе (fA) лежит в пределах 10 -10 . Концентрация А зависит от его давления и температуры.
20
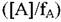 лежит в пределах 50-75 кДж/моль. лежит в пределах 50-75 кДж/моль.
На эту величину E1 должна быть меньше Е2 и Е3, для того чтобы скорость хемосорбции, отнесенная к одному свободному участку поверхности (w1/[K]), была бы близка к соответствующим скоростям второй (w2/[X]) и третьей (w3/[Y]) стадий.
Если при некоторой температуре w1/[K] имеет тот же порядок, что w2/[X] и w3/[У], то при повышении температуры первая величина станет меньше остальных и стадия хемосорбции будет лимитирующей. При этом снизятся наблюдаемая энергия активации и стационарная концентрация X.
В предельном случае стабильное хемосорбированное состояние реактанта может не возникать и взаимодействие с твердым катализатором ограничится образованием одного активированного комплекса с участием катализатора, превращение которого приведет сразу к продуктам реакции и освобождению участка поверхности катализатора. Соответствующий путь каталитической реакции изобразится линией I—4—VI на рис. 2.2.
В проведенном анализе предполагалась необратимость всех стадий. В случае обратимости быстрые стадии будут приводить к достижению равновесных концентраций промежуточных продуктов. Так, например, если стадии хемосорбции реактанта и десорбции продуктов протекают быстрее стадии химического превращения и приводят к достижению равновесных значении [Хi]p и [Yi]p по отношению к концентрациям в газовой фазе, то скорость реакции
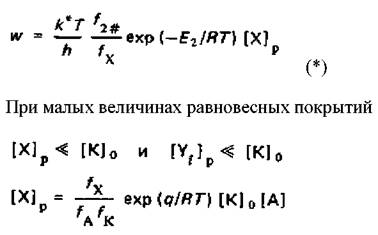
где qA теплота хемосорбции реактанта; [К]0 - общее число участков на поверхности катализатора, на которых может происходить хемосорбция А, отнесенное к 1 см3 газовой фазы,
Подставив значение [X]p в (*), находим
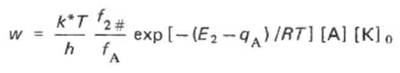
т.е. скорость реакции при постоянном ЕA возрастает с увеличением теплоты хемосорбции, определяющей равновесное покрытие.
Сопоставляя реакционный путь с участием твердого катализатора (линия I–II–1–III–2–IV–3–V–VI на рис. 2.2) с энергией активации без катализатора (линия I–5–VI на рис. 2.2), иногда вводят понятие теплоты адсорбции активированного комплекса, понимая под ней разность энергий активированного комплекса некаталитической реакции и одного из активированных комплексов той же реакции в случае гетерогенного катализа. В рассмотренном выше случае мономолекулярной реакции с лимитирующей стадией химического превращения и равновесием хемосорбции теплота адсорбции активированного комплекса равна уменьшению энергии активации каталитической реакции по сравнению с реакцией без участия катализатора. Для той же реакции в случае быстрой и необратимой хемосорбции реактанта уменьшение энергии активации при осуществлении реакции по каталитическому пути равно разности теплот хемосорбции активированного комплекса и реактанта. Надо заметить, что понятие теплоты адсорбции активированного комплекса носит формальный характер и неплодотворно. Так, в рассматриваемом случае мономолекулярной реакции реакционный путь проходит через три энергетических максимума. Неясно, который из них надо рассматривать как продукт активированного комплекса некаталитической реакции, тем более что каждый из них в определенных случаях может отвечать лимитирующей стадии.
Забиваем Сайты В ТОП КУВАЛДОЙ - Уникальные возможности от SeoHammer
Каждая ссылка анализируется по трем пакетам оценки: SEO, Трафик и SMM.
SeoHammer делает продвижение сайта прозрачным и простым занятием.
Ссылки, вечные ссылки, статьи, упоминания, пресс-релизы - используйте по максимуму потенциал SeoHammer для продвижения вашего сайта.
Что умеет делать SeoHammer
— Продвижение в один клик, интеллектуальный подбор запросов, покупка самых лучших ссылок с высокой степенью качества у лучших бирж ссылок.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз,
а первые результаты появляются уже в течение первых 7 дней.
Зарегистрироваться и Начать продвижение
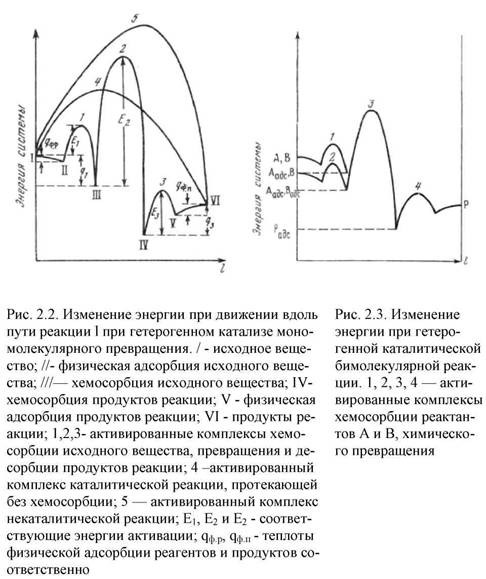
В случае бимолекулярных реакций гетерогенного катализа возможно несколько реакционных путей. Так, например, реакция
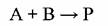
может осуществляться через стадии хемосорбции обоих компонентов, при предварительной хемосорбции только одного компонента и путем образования активированного комплекса стадии химического превращения из молекул реактантов газовой фазы и катализатора без их предварительной хемосорбции. Энергетическая схема первого случая
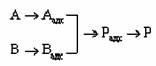
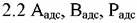 - хемосорбированные реактанты и - хемосорбированные реактанты и
продукты.
Для осуществления стадии химического превращения хемосорбированные реактанты должны располагаться рядом на поверхности катализатора или достаточно быстро именять свое положение путем поверхностной диффузии или в результате обратимост хемосорбции. Если эти процессы протекают с большой скоростью и покрытие поверхности хемосорбированными реактантами велико, то этому пути отвечает наибольша величина предэкспоненциального множителя в выражении для скорости реакции. Рассмотренный вариант протекания бимолекулярной реакции часто называют "механизмом Лэнгмюра— Хиншелвуда". На рис. 2.3 десорбция продуктов реакции npeдставлена протекающей через один активированный комплекс 4; вообще говоря, десорбция каждого продукта характеризуется отдельной величиной энергии активации, различной для разных продуктов.
При втором варианте
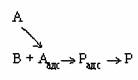
энергетическая схема изобразится линией, аналогичной линии I–1–2–3– VI (см рис. 2.2) для мономолекулярной реакции. Подвижность хемосорбированного реактанта не имеет значения, но величина предэкспоненты может быть меньше, так как один из реактантов участвует в образовании активированного комплекса химического превращения из газовой фазы.
Еще меньше величина предэкспоненты при третьем варианте, когда активированный комплекс химического превращения образуется с участием газообразных молекул обоих компонентов:
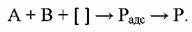
Здесь - свободный активный участок поверхности катализатора, на котором возможно протекание реакции по третьему варианту.
Во многих случаях бимолекулярные реакции гетерогенного катализа протекают по еще более сложным схемам в результате диссоциативной хемосорбции реактантов, многократных превращений реагирующих веществ с выделением промежуточных продуктов в газовую фазу, взаимодействия промежуточных продуктов с реактантами и т.п. Это часто приводит к разнообразию конечных продуктов и сложным кинетическим закономерностям реакций гетерогенного катализа.
|