Вторичная переработка полимеровФотоанти оксиданты
В отличие от полимеров с собственным поглощением ключевым моментом в стабилизации полимеров, разрушающихся из-за наличия примесей, является, лрежде всего, минимизация образования хромофоров. Важно обеспечить эффективную стабилизацию расплава, чтобы предотвратить образование хромофоров на стадии производства. После того как полимер приготовлен, стабилизация мо-кет быть достигнута посредством поглощения УФ-света или захватом свободных радикалов или нероксидов как при термодеструкции.
Поскольку химия окисления полиолефинов в своей основе одинакова под действием как света, так и тепла, фенольные и аминные антиоксиданты должны были бы быть эффективными стабилизаторами. На практике это не так, потому что и те и другие, и продукты их реакций быстро разрушаются в ходе фотореак-иий. Пероксидолитические антиоксиданты тина сульфосодержащих соединений эффективны против УФ-стимулированной деструкции, потому что они разрушают пероксиды, конкурируя с фотолизом. Необходимо выбирать структуры, устойчивые к УФ-свету.
Большим достижением для наружного использования полиолефинов было появление блокированных аминных световых стабилизаторов (БАСС), основанных на стерически блокированных тетраметилпиперидиновых ядрах.
Эти соединения способны стабилизировать полиолефины, особенно полипропилен, против погодного воздействия в течение гораздо более продолжительного времени, чем любой другой стабилизатор. Они широко распространены в качестве стабилизаторов для полиолефинов и многих поверхностных покрытий. Они не поглощают в УФ-области и имеют собственную небольшую способность к захвату радикалов, поэтому поначалу механизм их действия оставался покрытым тайной и многократно обсуждался [51, 55-58]. Сейчас остались некоторые спорные детали, но общепринято, что, когда пероксирадикалы генерируются в присутствии БАСС, БАСС окисляется и производит нитроксидные радикалы [59].
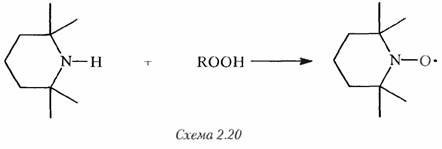
Эти радикалы являются очень сильными антиоксидантами, прерывающими цепь, по-видимому, по механизму, показанному на схеме 2.21
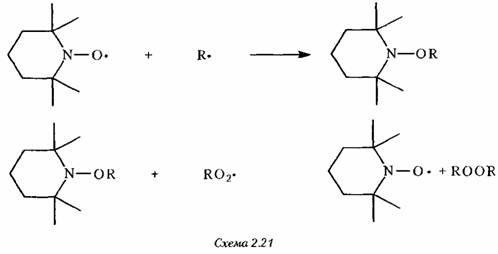
Ввиду циклической регенерации нитроксидов каждый из них может захватить множество радикалов. Это, вместе с их устойчивостью к фотохимическому распаду, обусловливает высокую эффективность стабилизации.
Хотя БАСС изначально разрабатывались как фотостабилизаторы, недавно было показано, что они хорошо работают и в качестве стабилизаторов против термоокисления при низких температурах, хотя действуют скорее как замедлители, а не как ингибиторы [60]. Их использование в качестве термостабилизаторов быстро растет, и теперь их чаще называют БАС (блокированные аминные стабилизаторы), чем БАСС. Однако они не дают эффекта при температурах производства полимеров; то есть полимер должен содержать также технологический стабилизатор.
Различное действие фенольных антиоксидантов и БАС, по-видимому, связано с различием в механизме действия и изменении механизма деструкции ПП с температурой [60]. При высоких температурах деструкция ПП идет главным образом за счет окисления собственно полимера, тогда как при низких температу-ах превалирует окисление продуктов окисления. Вторичное окисление через чьдегиды дает перкислоты; оно определяет скорость окисления при низких температурах. Модельные эксперименты показывают, что БАС способны предотвращать окисление альдегидов, но не прямое окисление углеводородов, доминирующее при высоких температурах.
Было показано, что, кроме захвата радикалов, БАС и вторичные нитроксиды обладают свойством разлагать пероксиды и дезактивировать металлы, что также усиливает их эффективность.
Синергизм в химии антиоксидантов
Прерывающие цепь антиоксиданты ингибируют образование пероксидов и снижают нагрузку на разлагающие пероксиды антиоксиданты. Защитные антиокси-анты разлагают пероксиды и предотвращают образование радикалов, разрушающих антиоксиданты, прерывающие цепь. Таким образом, смеси антиоксидантов двух типов могут оказаться существенно более эффективными, чем отдельные антиоксиданты. Этот эффект называется синергизм, и его роль значительна при выборе состава антиоксидантов.
После признания синергизма стало логичным попытаться придать функции прерывания цепи и разложения пероксидов одной и той же молекуле, и молекулы, содержащие фенольную единицу и атом серы или фосфора в одной структурной группе, теперь — обычное дело [40,41].
 — достаточно сильные лыоисов-ские кислоты, они могут катализировать исключение ПС1 но ионному пути. Карбоксилаты бария и кальция, напротив, плохие акцепторы хлора, а соответствующие хлориды — слабые льюисовские кислоты. Эти соли синергизируются с солями цинка и кадмия, реагируя с галогенидами с регенерацией активного карбоксилата. Тио-гликоляты олова являются самыми сильными стабилизаторами ПВХ, потому что они действуют, по крайней мере, по трем синергическим направлениям. Они дезактивируют активный хлор, разлагают гидропероксиды и удаляют аллиловые двойные связи присоединением освобожденного тиогликолевого эфира. Кроме того, они гораздо более благоприятны для окружающей среды, чем соли тяжелых металлов и в настоящее время служат основными стабилизаторами для ПВХ (вместе с быстро развивающимися полностью неметаллическими стабилизаторами) [61]. — достаточно сильные лыоисов-ские кислоты, они могут катализировать исключение ПС1 но ионному пути. Карбоксилаты бария и кальция, напротив, плохие акцепторы хлора, а соответствующие хлориды — слабые льюисовские кислоты. Эти соли синергизируются с солями цинка и кадмия, реагируя с галогенидами с регенерацией активного карбоксилата. Тио-гликоляты олова являются самыми сильными стабилизаторами ПВХ, потому что они действуют, по крайней мере, по трем синергическим направлениям. Они дезактивируют активный хлор, разлагают гидропероксиды и удаляют аллиловые двойные связи присоединением освобожденного тиогликолевого эфира. Кроме того, они гораздо более благоприятны для окружающей среды, чем соли тяжелых металлов и в настоящее время служат основными стабилизаторами для ПВХ (вместе с быстро развивающимися полностью неметаллическими стабилизаторами) [61].
|