Коррозия и защита от коррозииЗакономерности кинетики электродных реакций
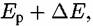 то начинается направленный переход электронов то начинается направленный переход электронов
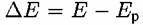 при прохождении тока через электрод называется поляризацией электрода. при прохождении тока через электрод называется поляризацией электрода.

Изучение кинетики электродного процесса состоит в установлении связи между поляризацией электрода АЕ и скоростью электрохимической реакции г.
Графическую зависимость плотности тока от потенциала называют поляризационной кривой и широко используют при изучении коррозионных процессов.
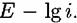 В отличие от этого, так называемого гальваностатического метода измерений, существует метод потенциостатический, при котором задают постоянные во времени значения потенциала основного электрода по отношению к электроду сравнения (с помощью специальных приборов - потенциостатов) и измеряют токи в цепи основной-вспомогательный электроды. В отличие от этого, так называемого гальваностатического метода измерений, существует метод потенциостатический, при котором задают постоянные во времени значения потенциала основного электрода по отношению к электроду сравнения (с помощью специальных приборов - потенциостатов) и измеряют токи в цепи основной-вспомогательный электроды.
Важным признаком электрохимических реакций является эквивалентность их скорости плотности тока г. Такая эквивалентность следует из закона Фарадея. Сущность этого закона состоит в том, что, например, для реакции растворения металла величина потери массы металла в течение определенного времени позволяет рассчитать скорость его растворения, а из нее — плотность анодного тока:

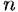 — число электронов, Р — число Фарадея, т — время. — число электронов, Р — число Фарадея, т — время.
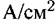 ). ).
Любой электродный процесс состоит из ряда стадий. К ним относятся:
подвод реагирующих веществ к поверхности электрода из объема раствора;
перенос заряженных частиц (электронов или ионов) через границу раздела фаз;
отвод продуктов реакции в объем раствора.
Скорость электродного процесса определяется скоростью самой медленной стадии, которая называется лимитирующей.
Если скорость электрохимической реакции определяется стадиями массопереноса, то возникает концентрационная поляризация. Кинетика процесса в этом случае лимитируется диффузией, основные закономерности которой будут рассмотрены ниже.
|