Коррозия и защита от коррозииМеханизм анодного растворения сплавов
В предыдущих разделах были рассмотрены законы растворения индивидуальных металлов. При этом было показано, что эти законы применимы и для описания коррозионного поведения систем, состоящих из двух разных металлов, находящихся в растворе в контакте друг с другом. Иначе обстоит дело со сплавами, представляющими собой твердые растворы. Простое приложение к ним представлений, развитых для индивидуальных металлов, оказывается недостаточным. Ряд особенностей коррозионно-электрохимического поведения сплавов может быть объяснен только при дополнительном привлечении некоторых новых представлений.
Действительно, составляющие сплав металлы из-за различия их природы имеют разные скорости растворения и различаются по другим кинетическим характеристикам. В то же время в подавляющем большинстве случаев в стационарных условиях сплавы растворяются равномерно, т.е. их компоненты переходят в раствор с близкими скоростями. Объяснить это можно несколькими причинами.
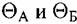 не достигнут значений, удовлетворяющих условию равномерного и стационарного растворения сплава. В этом случае соотношение концентраций ионов обеих металлов в растворе то же, что отношение масс этих металлов в сплаве. не достигнут значений, удовлетворяющих условию равномерного и стационарного растворения сплава. В этом случае соотношение концентраций ионов обеих металлов в растворе то же, что отношение масс этих металлов в сплаве.
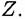 Это — величина, показывающая, во сколько раз отношение количеств А и Б в растворе отличается от отношения количеств этих металлов в сплаве. Например, для компонента А Это — величина, показывающая, во сколько раз отношение количеств А и Б в растворе отличается от отношения количеств этих металлов в сплаве. Например, для компонента А
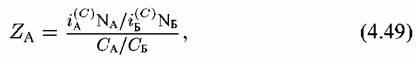
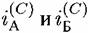 — скорости растворения в расчете на единицу видимой — скорости растворения в расчете на единицу видимой
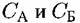 — концентрации А и Б в сплаве. — концентрации А и Б в сплаве.
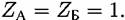
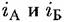 при растворении сплава (в расчете на единицу поверхности, занимаемой данным компонентом) такими же, какими они были при растворении соответствующих индивидуальных металлов. при растворении сплава (в расчете на единицу поверхности, занимаемой данным компонентом) такими же, какими они были при растворении соответствующих индивидуальных металлов.
В отличие от этого другой механизм — замедленная диффузия более активного компонента в объеме сплава — предполагает отличие
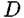 компонента А в слое 8. компонента А в слое 8.
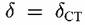 (обычно составляющей 10_6-10~5 см). Скорость растворения сплава в стационарном режиме лимитируется, таким образом, диффузией А в объеме сплава. (обычно составляющей 10_6-10~5 см). Скорость растворения сплава в стационарном режиме лимитируется, таким образом, диффузией А в объеме сплава.
Растворение сплавов по механизму замедленной диффузии А в твердой фазе, исследованное в работах В.В. Лосева и других ученых, доказано для латуней, сплавов олово-цинк, индий—цинк и многих других.
Растворение сплавов в условиях, когда скорость процесса достаточно велика, так что поверхностный слой измененного состава конечной толщины образоваться не может, происходит по механизму Колотыркина. Согласно этому механизму, один из компонентов сплава растворяется по кинетике, свойственной этому компоненту в индивидуальном состоянии, а переход в раствор второго компонента определяется поведением первого и потому описывается той же кинетикой. Поясним это.
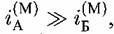 А в А в
начальной стадии растворения переходит в раствор с большей скоростью, оставляя на поверхности атомы Б. Лишенные связей с соседями, атомы Б приобретают способность переходить в раствор со скоростью, превышающей скорость растворения Б в индивидуальном состоянии. По причине некоторого снижения поверхностной концентрации А в этих условиях, скорость растворения А, напротив, понижается по сравнению со скоростью растворения А из чистой металлической фазы. Скорость выхода Б в раствор определяется
скоростью растворения А, поскольку чем эта последняя выше, тем больше вероятность потери атомами Б соседей и тем больше скорость их выхода из решетки.
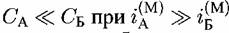 , поверхность в начальных стадиях процесса сильно обогащается компонентом Б. Скорость растворения сплава в целом определяется кинетикой растворения этого компонента, в то время как компонент А растворяется сразу после его попадания на поверхность (что возможно после растворения Б, который, таким образом, лимитирует скорость растворения А). Компонент Б в этих условиях играет определяющую роль, причем скорость его растворения хотя и слабо, но повышена по сравнению со скоростью растворения чистого металла. Компонент же А растворяется значительно медленнее, чем чистый металл, и по кинетике, предписываемой компонентом Б. , поверхность в начальных стадиях процесса сильно обогащается компонентом Б. Скорость растворения сплава в целом определяется кинетикой растворения этого компонента, в то время как компонент А растворяется сразу после его попадания на поверхность (что возможно после растворения Б, который, таким образом, лимитирует скорость растворения А). Компонент Б в этих условиях играет определяющую роль, причем скорость его растворения хотя и слабо, но повышена по сравнению со скоростью растворения чистого металла. Компонент же А растворяется значительно медленнее, чем чистый металл, и по кинетике, предписываемой компонентом Б.
В соответствии с механизмом Колотыркина, существуют граничные составы сплавов, характеризующие переход от сплавов, кинетика растворения которых определяется одним из компонентов, к сплавам, растворяющимся по кинетике, свойственной второму компоненту.
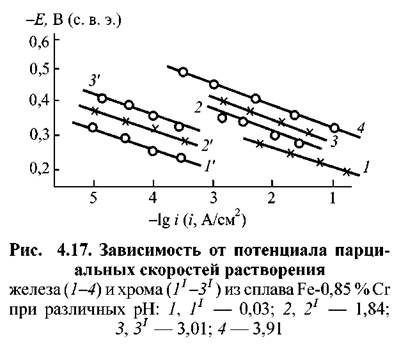
Изложенные представления можно иллюстрировать на примере коррозионно-электрохимического поведения сплавов железо-хром. Механизмы растворения составляющих эти сплавы металлов заметно отличаются друг от друга. Растворение железа, как указывалось выше, ускоряется с ростом рН раствора. Скорость того же процесса для хрома от кислотности не зависит.
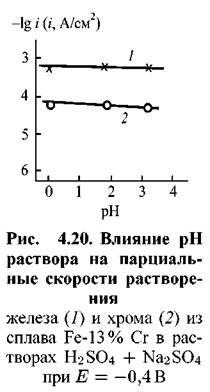
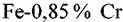 в растворах различной кислотности. Отношение количеств железа и хрома, переходящих в раствор, как это следует из сравнения токов на парциальных кривых для железа и хрома, хорошо согласуется с отношением этих элементов в исходном сплаве, что говорит о равномерном растворении сплавов. С ростом рН раствора скорость растворения железа из сплава при всех потенциалах возрастает. То же наблюдается и для растворения хрома из сплава. в растворах различной кислотности. Отношение количеств железа и хрома, переходящих в раствор, как это следует из сравнения токов на парциальных кривых для железа и хрома, хорошо согласуется с отношением этих элементов в исходном сплаве, что говорит о равномерном растворении сплавов. С ростом рН раствора скорость растворения железа из сплава при всех потенциалах возрастает. То же наблюдается и для растворения хрома из сплава.
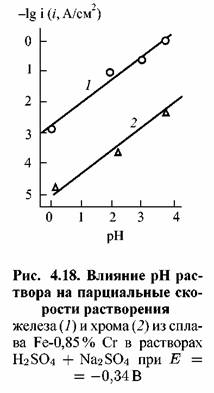
Результаты, представленные на рис. 4.17, суммированы на рис. 4.18. Последний показывает, что закономерности влияния рН на кинетику активного растворения
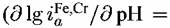 = 1). Иная картина наблюдается для сплава с 13 % Сг. В этом случае, как следует из рисунков 4.19 и 4.20, указанные закономерности совпадают с известными для хрома. = 1). Иная картина наблюдается для сплава с 13 % Сг. В этом случае, как следует из рисунков 4.19 и 4.20, указанные закономерности совпадают с известными для хрома.
Рис. 4.17-4.20 показывают, что сплавы Ре-Сг можно разделить
 сохраняется в течение всего последующего периода растворения сплава. Причина такого явления заключается в том, что, перейдя в раствор в заметных количествах, компонент Б снова осаждается на электроде. Осаждение происходит электрохимически и возможно потому, что состав поверхностного слоя на электроде становится отличным от исходного состава сплава. В этом случае на поверхности сплава удается наблюдать нарастание толстого пористого осадка чистого металла Б. Растворение сплавов по механизму такого обратного осаждения более благородного компонента называется псевдоизбирателъным. сохраняется в течение всего последующего периода растворения сплава. Причина такого явления заключается в том, что, перейдя в раствор в заметных количествах, компонент Б снова осаждается на электроде. Осаждение происходит электрохимически и возможно потому, что состав поверхностного слоя на электроде становится отличным от исходного состава сплава. В этом случае на поверхности сплава удается наблюдать нарастание толстого пористого осадка чистого металла Б. Растворение сплавов по механизму такого обратного осаждения более благородного компонента называется псевдоизбирателъным.
|